Cromatografia de Troca Iônica (IEC ou IEX)
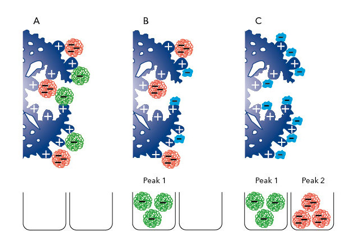
Princípio de separação catiônica
A) Proteínas com cargas negativas diferentes se ligam à resina de troca catiônica
B) Através do incremento de concentração de sal, proteínas com carga negativa mais fraca eluem primeiro
C) Com concentrações de sal cada vez mais altas, as proteínas mais fortemente carregadas eluem por último.
A cromatografia de troca iônica, uma técnica de biocromatografia também conhecida como IEC ou IEX, é um processo de cromatografia que separa íons e moléculas polares com base em sua afinidade com a resina da coluna trocadora de íons. O ponto isoelétrico (pI) é o pH onde a proteína possui carga líquida zero. Dependendo do pH da solução-tampão, a proteína de interesse assume cargas superficiais líquidas diferentes. Os dois tipos de cromatografia iônica são troca aniônica e troca catiônica.
Em um pH acima do pI, as proteínas assumem carga líquida negativa e se ligam a resinas carregadas positivamente (trocadores aniônicos). Ao contrário, em um meio de pH abaixo do pI, as proteínas assumem carga superficial líquida positiva e se ligam a resinas carregadas negativamente (trocadores catiônicos). Essa interação é utilizada para a separação de várias proteínas.
Usando-se um pH apropriado e uma baixa condição salina, as proteínas se ligam à resina no passo inicial (Figura 1A). As proteínas são separadas principalmente com um gradiente salino linear. Os íons de sal competem com as proteínas pelos sítios ativos da resina. Proteínas com interações iônicas fracas são as primeiras a eluir da coluna. No caso de uma cromatografia de troca catiônica, as proteínas mais fracas negativamente começam a eluir primeiro (Figura 1B). Com um aumento de concentração de sal, as proteínas com uma interação iônica mais forte eluirão depois das colunas (Figura 1C).
Princípios da técnica:
- Uma resina carregada positivamente tenderá a ligar-se a biomoléculas com uma carga negativa líquida e vice-versa;
- A eluição é obtida quando a solução tampão passa em quantidades crescentes de sal (por exemplo, NaCl), através de um gradiente;
- Os íons sódio ou cloreto competem com a ligação entre a resina e as biomoléculas;
- Ordem de eluição: depende da carga líquida, quanto menos carregada a biomolécula, primeiro ela elui.
Resultados:
α- Quimotripsinogênio A (pI 8,97) e Lisozima (pI 11,35) são proteínas com um valor de pI altos, que os torna candidatos ideais para a cromatografia de troca catiônica (Fig.2). Ambas proteínas se ligam à resina sob baixas condições salinas. Durante o passo de lavagem que remove proteínas potenciais que não são ligantes, só uma pequena quantidade de impurezas eluem da coluna. α- Quimotripsinogênio A elui primeiro da coluna devido ao seu pI mais baixo de 8,97 (Fig. 2, pico 1). Com um gradiente incremental e portanto aumento da concentração salina, a Lisozima elui depois (Fig. 2, pico 2). As proteínas eluídas foram automaticamente coletadas por um coletor de frações. O gradiente salino foi monitorado pelo monitor de condutividade (Fig. 2, sinal vermelho).
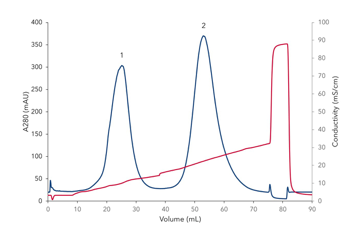
(Fig.2)
Cromatograma de de separação de dois tipos de proteínas com cromatografia de troca iônica, linha azul – sinal de UV 280nm, linha vermelha – sinal do condutivímetro, 1) pico contendo α- Quimotripsinogênio A (2,5 mg/mL), 2) pico contendo Lisozima (2,5 mg/mL)
Materiais e Métodos
Nessa aplicação, no sistema de purificação AZURA® Bio consiste de:
- Uma bomba AZURA® P 6.1L LPG livre de metais, com um cabeçote de 10 mL;
- Um módulo assistente AZURA® ASM 2.1L com bomba de alimentação e duas válvulas de injeção;
- Um detector duplo diodo AZURA® DAD 2.1L com 10mm e célula de fluxo de 10µL;
- Um monitor de condutividade AZURA® CM 2.1S;
- Um coletor de frações Foxy R1.
Antes da corrida, a coluna de troca catiônica de 1mL (HiTrap Capto S) foi equilibrada com 10mL de solução tampão A (20mM tampão fosfato pH 7.1).
A vazão da corrida foi de 2 mL/min. Foram injetados 500µL da mistura de proteína ( α- Quimotripsinogênio A 2.5mg/mL e Lisozima 2.5mg/mL).
Em seguida, a coluna foi lavada com 4mL de tampão A para remover toda a proteína não ligante.
As duas proteínas foram eluídas com um gradiente linear sobre um volume total de 70mL.
A concentração de sal aumentou com o aumento da concentração do tampão B (20mM de tampão fosfato pH 7.1 + 1M NaCl) em um gradiente de 0% a 30%. As proteínas eluídas foram coletadas em um coletor de frações. A coluna foi regenerada com uma lavagem de alta concentração de sal de 6mL do tampão B, seguida pelo re-equilíbrio da coluna com 10mL de tampão A. As proteínas foram detectadas a 280nm e o sinal de condutividade foi gravado para monitorar o gradiente de sal.
Conclusão
Esta aplicação bastante direta ilustra o princípio da cromatografia de troca iônica, uma das técnicas da biocromatografia. Dois tipos de proteínas com cargas superficiais diferentes eluíram com um aumento da concentração salina de uma coluna de troca catiônica. As proteínas podem ser facilmente separadas na cromatografia de troca catiônica com o sistema de purificação AZURA® Bio.
Materiais adicionais e Métodos
Parâmetros do método
| Eluente A | 20mM tapão fosfato pH 7.1 | ||||||||||||||||||||||||
| Eluente B | 20mM tampão fosfato pH 7.1 + 1M NaCl | ||||||||||||||||||||||||
| Gradiente |
| ||||||||||||||||||||||||
| Vazão | 2mL/min | ||||||||||||||||||||||||
| Corrida | 45 min | ||||||||||||||||||||||||
| Temperatura da coluna | 25oC | ||||||||||||||||||||||||
| Volume de injeção | 0,5mL | ||||||||||||||||||||||||
| Modo injeção | loop cheio | ||||||||||||||||||||||||
| Taxa de dados | 2Hz | ||||||||||||||||||||||||
| Comprimento de onda | 280nm | ||||||||||||||||||||||||
| Constante de tempo | 500ms |
Configuração do sistema & dados
| Instrumento | Descrição |
| Bomba | AZURA® P 6.1L LPG livre de metais |
| Detector | AZURA® DAD 2.1L |
| Célula de fluxo | 10mm, 10µL, Ti, 300bar |
| Assistente | AZURA® ASM 2.1L |
| Esquerda | Bomba com sensor de pressão, cabeçote da bomba de 50mL, titânio |
| Meio | Válvula de injeção de 6 portas e 2 posições, conectores de 1/16” |
| Direita | Válvula de injeção de 6 portas e 2 posições, conectores de 1/16” |
| Coletor de frações | Foxy R1 |
| Monitor de condutividade | AZURA® CM 2.1S |
| Coluna | Capto S, GE Healthcare, HiTrap, 1mL |
| Software | PurityChrom 3D Option |
Já conhece nossos cursos? Saiba mais aqui!



